2008 год
Важнейшие результаты 2008 год
ИЛЛЮСТРАТИВНОЕ КРАТКОЕ ИЗЛОЖЕНИЕ ВАЖНЕЙШИХ РЕЗУЛЬТАТОВ ЗАВЕРШЕННЫХ ФУНДАМЕНТАЛЬНЫХ ИССЛЕДОВАНИЙ
На основе новых разработанных статистических методов и алгоритмов генетического анализа из огромного потока данных о последовательности нуклеотидов у различных членов родословной получена информация о генетическом контроле сложных признаков. Возможно-сти новых методов продемонстрированы на примере роста человека. Все известные до на-стоящего времени гены, контролирующие рост человека, объясняют только 5 % разнообразия признака. При помощи созданных методов выявлены новые гены, влияющие на этот признак. Было проанализировано около 3000 представителей единой родословной, генотипированных по 6000 SNP маркеров, и обнаружено 3 района на хромосомах 1, 2 и 16, которые оказывают значимое влияние на рост. Первый является местом локализации уже описанного гена COL9A2. Два других района содержат ранее не описанные гены. (Приоритетное направле-ние РАН 6.9.; Программа СО РАН 6.9.1.; ИЦиГ СО РАН).
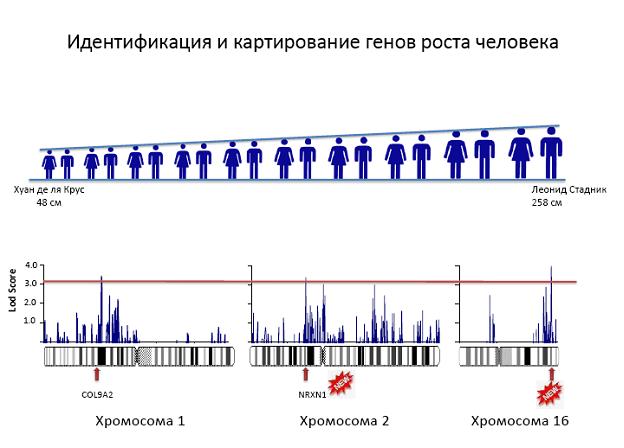
Рис. 1. Результаты полногеномного картирования роста человека.
На графиках представлены значения Lod Score на трех хромосомах, показавших значимое сцепление (Lod Score ? 3.3). Внизу – диаграммы соответствующих хромосом и выявленные гены-кандидаты. Пик на хромосомах 1 находится в районе локализации известного генов, влияющего на рост человека. На хромосомах 2 и 16 обнаружены новые гены, детерминирующие этот признак.
На основе разработанных методов хромосомной инженерии созданы иммунные ли-нии сорта мягкой пшеницы Саратовская 29. Эти линии являются донорами генов, контро-лирующих высокое содержание белка в зерне и устойчивость к листовым патогенам – мучнистой росе и бурой ржавчине. Гены, контролирующие высокое содержание белка в зерне и адаптивные признаки перенесены от дикорастущих сородичей пшеницы – T. timopheevii (GGAtAt) и T.tauschii (D’D’). Генотипирование иммунных линий с использованием молекулярных маркеров выявило, что их хромосомы являются рекомбинантными за счет включения сегментов хромосом дикорастущих сородичей пшеницы в геном мягкой пшеницы (рис. 2). Иммунные линии включены в селекционный процесс и на их основе получены перспективные гибридные формы – кандидаты для получения новых сортов яровой мяг-кой пшеницы. (Приоритетное направление РАН 6.4.; Программа СО РАН 6.4.1.; ИЦиГ СО РАН).
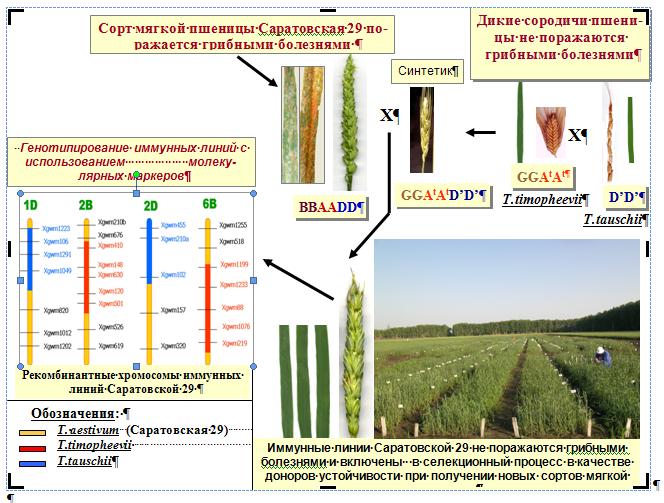
Рис. 2. Схема создания и изучения иммунных линий мягкой пшеницы сорта Саратовская 29.
Показано, что крысы с наследственной стресс-индуцированной артериальной гипертензией (линия НИСАГ) отличаются от контрольных нормотензивных крыс линии WAG по ряду признаков, характерных для такого комплексного заболевания человека, как метаболический синдром, сопровождаемый повышением артериального давления. У крыс линии НИСАГ обнаружены: атерогенный сдвиг липидного спектра крови (по-вышенное содержание триглицеридов и липопротеинов очень низкой плотности в плазме крови), повышенная масса тела, повышенный базальный уровень глюкозы и снижение толерантности к сахарной нагрузке. Этот симптомокомплекс сопровождается изменениями функциональной активности ядерных транскрипционных факторов (рис. 3), участвующих в регуляции липидного и углеводного обменов, таких как PPAR, PXR, LXR, CAR, что отражает транскрипционные механизмы формирования симптомов, характерных для метаболического синдрома. (Приоритетное направление РАН 6.11.; Программа СО РАН 6.11.1.; ИЦиГ СО РАН).
PPAR, представленный тремя изоформами, участвует в регуляции экспрессии генов липидного и углеводного обмена, в том числе, апо А-I. LXR, имеющий две изоформы, также имеет сайты посадки в регуляторных участках генов, имеющих отношение к липидному и уг-леводному обменам, например, гена аденозинтрифосфат-связывающего кассетного белка (ABCA-1), который принимает участие в опосредованном апо А-I транспорте холестерина из клетки. CAR и PXR посредством активации стеароил-КоА-десатуразы-1 (SCDA-1) переводит насыщенные жирные кислоты в мононенасыщенную форму, таким образом стимулируя липо-генез.

Рис. 3. ДНК-связывающая активность ядерных транскрипционных факторов:
CAR, PXR, PPAR, LXR, HNF-4.
Номера дорожек:
0 – зонд, 1 – зонд после инкубации с экстрактом ядер клеток печени крыс линии WAG, 2 – зонд после инкубации с экстрактом ядер клеток печени крыс линии ISIAH.
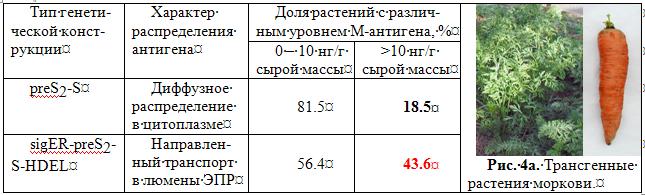
Созданы трансгенные растения моркови в качестве кандидатной съедобной вакцины против возбудителя гепатита В человека (рис. 4а). Для трансформации использовали генетические конструкции с генами поверхностных белков вируса: preS2-S (обеспечивает накопление М-антигена в цитозоле) и sigER-preS2-S-HDEL (обеспечивает направленный транспорт того же антигена в люмены эндоплазматического ретикулума). Установлено, что направленный транспорт М-антигена в люмены эндоплазматического ретикулюма увеличивает долю (до 43,6 %) трансформантов с высоким (более чем 10 нг/г сырой массы) уровнем накопления исследуемого белка (таблица). (Приоритетное направление РАН 6.10.; Программа СО РАН 6.10.1.; ИЦиГ СО РАН).
Рис. 4а. Сравнительный анализ уровня накопления М-антигена у трансгенных растений с диффузным распределением и направленным транспортом целевого белка.
Отработаны методы выделения, иммунофенотипирования и культивирования клеток эпителиального слоя тонкого кишечника для оценки пути прохождения рекомбинантного белка (ИЛ-18) через желудочно-кишечный тракт до клеток кишечного эпителия (Рис. 4б).
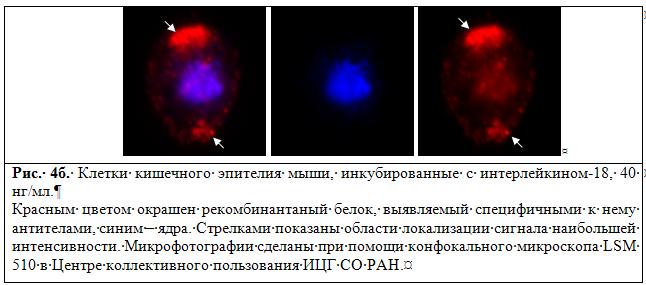
Работа выполняется совместно с Государственным научным центром вирусологии и био-технологии «Вектор» и Институтом химической биологии и фундаментальной медицины СО РАН.
Разработан новый компьютерный метод PHASE для предсказания сайтов формирования нуклеосом в нуклеотидных последовательностях геномной ДНК эукариот. На его основе установлены общие закономерности расположения нуклеосом на хромосомной ДНК человека. Оказалось, что сайты с высоким потенциалом формирования нуклеосом распределены вдоль геномной ДНК существенно более равномерно, чем сайты с низким потенциалом формирования нуклеосом (рис. 5), которые сгруппированы в пределах относительно малого числа кластеров. Эта закономерность показана также для хромосом других таксонов эукариот (дрозофилы и дрожжей). Полученные результаты хорошо согласуется, с тем, что большая часть геномной ДНК должна в обязательном порядке поддерживать регулярное расположение нуклеосом, то есть наиболее важна регулярная, в первом приближении равномерная плотность расположения последовательностей, обладающих повышенной способностью к формированию нуклеосом. (Приоритетное направление РАН 6.9.; Программа СО РАН 6.9.1.; ИЦиГ СО РАН).
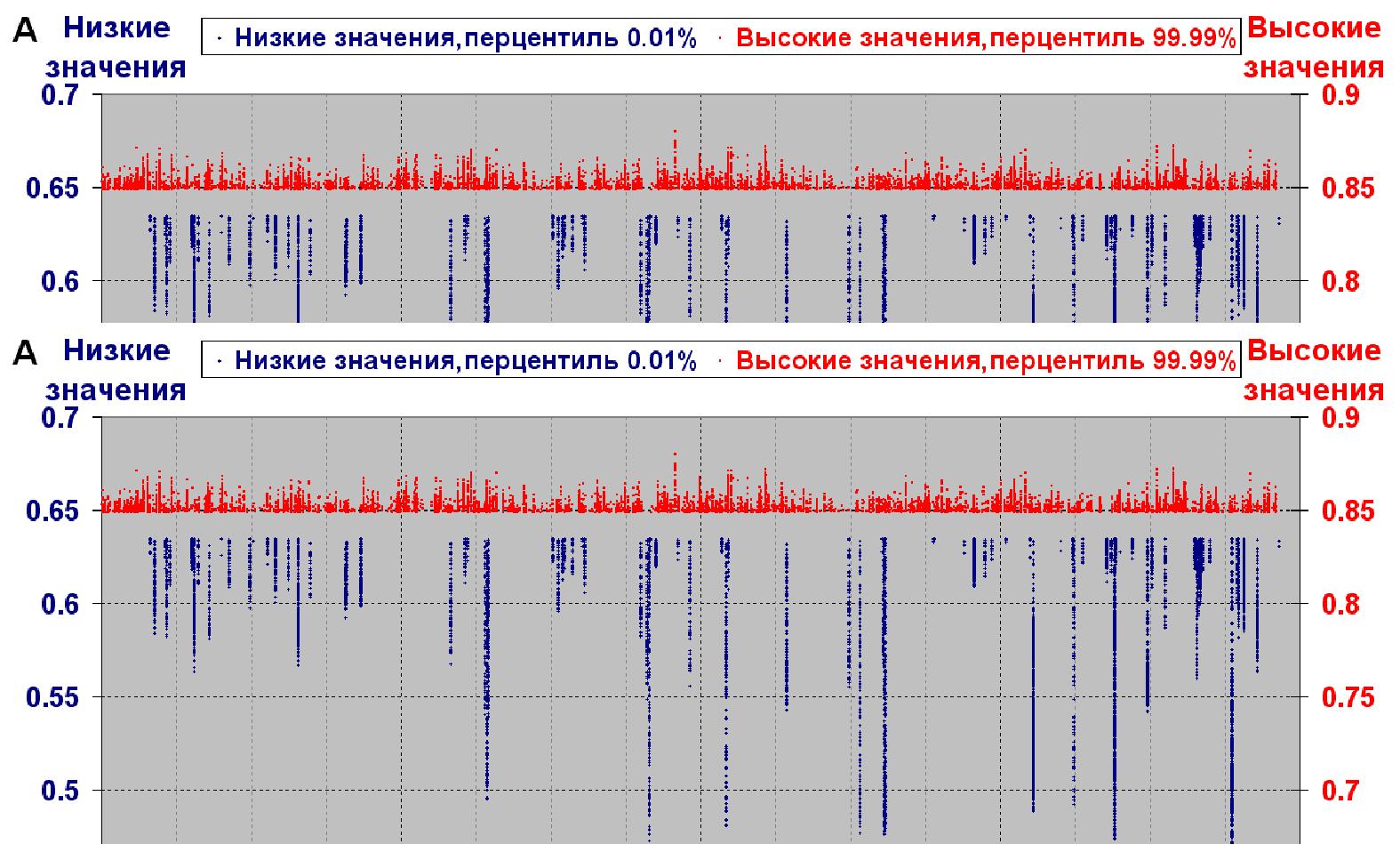
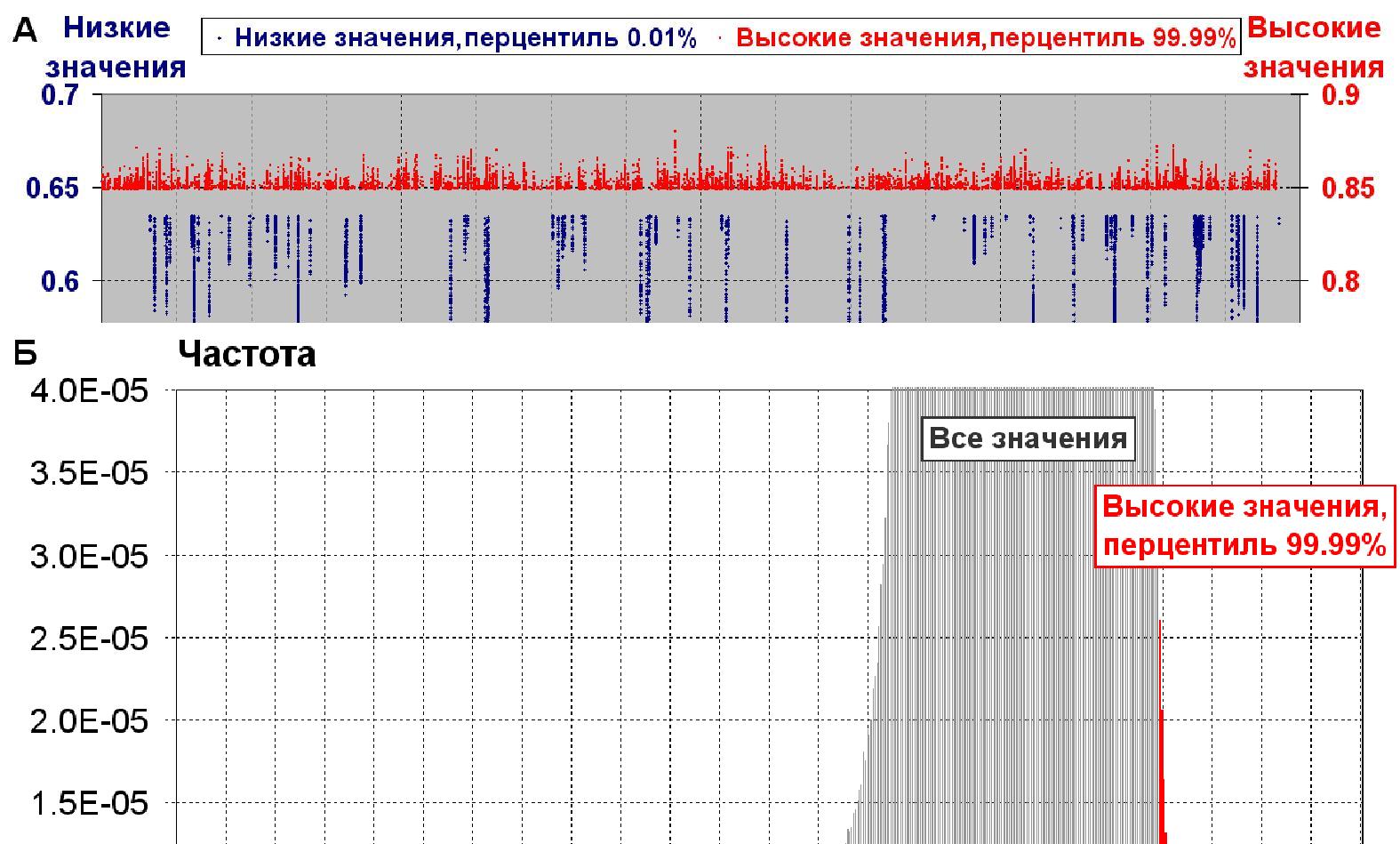
Рис. 5. Локализация сайтов с высоким и низким потенциалом формирования нуклеосом вдоль геномной ДНК эукариот.
(а) Профиль локализации сайтов с высокими и низкими значениями потенциала формирования нуклеосом вдоль 17-й хромосомы человека.
(б) Распределение величины потенциала формирования нуклеосом для 17-й хромосомы чело-века. Синим и красным цветом отмечены левый и правый хвосты распределения, соответст-вующие низким и высоким значениям потенциала (перцентили 0.01 % и 99.99 %).
Исследована молекулярно-генетическая организация индивидуального района интеркалярного гетерохроматина из района 75С политенных хромосом дрозофилы. Установлено, что район 75С1-2 составляет в длину около 450 т.п.н., в нем расположено около 25 генов (рис. 6). Район проявляет свойства поздней репликации, связывает белок SUUR, зона недорепликации занимает 60 % длины ДНК района, в ней локализован участок «слабой точки», в которой происходят разломы хромосомы. Гены этого района экспрессируются скоординировано. (Приоритетное направление РАН 6.1.; Программа СО РАН 6.1.1.; ИЦиГ СО РАН).
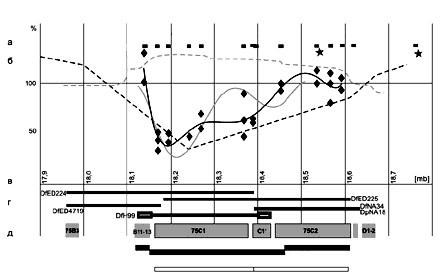
Рис. 6. Молекулярная и цитологическая организация района 75С.
а – положение использованных ДНК-зондов (прямоугольники), звездочки обозначают поло-жения сайтов рестрикции NotI; б – кривые степени политенизации по данным Саузерн-блот анализа для 2 копий гена SuUR (черная линия и ромбы) и по данным анализа на микрочипах для 4 копий гена SuUR (Belyakin et al., 2005) (серая линия); профиль связывания SUUR (серая пунктирная линия) (Pindyurin et al., 2007) и профиль времени репликации (черная пунктирная-линия) в клетках Kc (Schubeler et al., 2002); уровень 100 % соответствует полностью политени-зированным эухрома-тиновым последовательностям со средним временем начала репликации; в – геномные координаты хромосомы 3L D. melanogaster (release 5.1); г – положение точек разрыва хромосомных перестроек; д – положение дисков 75C1–75C2 и ряда соседних дисков (черные прямоугольники), а также зоны недорепликации и зоны формирования «пузырей» (белые прямоугольники).
Открыто новое явление – альтернативное доминирование родительских геномов в гиб-ридных клетках. Ранее показано, что в гибридных клетках, полученных слиянием эмбриональных стволовых клеток (ЭСК) с фибробластами, доминирует геном ЭСК, а геном фибробласта перепрограммируется. Однако анализ ранних стадий образования гибридных клеток показал, уже на стадии гетерокариона они приобретают характеристики либо ЭСК (рис. 7 слева), либо фибробласта (рис. 7 справа). В дальнейшем (через 24-48 часов) из гетерокарионов формируются два типа клонов гибридных клеток, в которых доминирует геном ЭСК или фибробласта. Таким образом, судьба гибридных клеток на ранних стадиях после слияния дуалистична, они могут развиться как по типу ЭС клеток, так и фибробластов. Впервые показано, что этот «выбор» судьбы определяется до первого деления. (Приоритетное направление РАН 6.8.; Программа СО РАН 6.8.1.; ИЦиГ СО РАН).
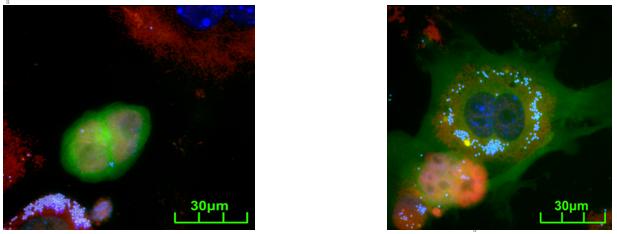
Рис. 7. Два типа морфологии гетерокарионов через 20 ч после слияния ЭС клеток с фибробла-стами: слева – типа ЭСК, справа – типа фибробласта. Видно, что ядра гетерокариона типа ЭСК позитивны по Nаnog (окраска красного цвета), тогда как типа фибробласта отрицательны, но позитивны по коллагену 1-го типа (красная цитоплазма). Гетерокарион фибробластного типа позитивен по коллагену 1-го типа (цитоплазма окрашена красным и содержит синие гранулы), рядом две ЭС клетки позитивные по Nаnog.
Разработана высокотехнологичная и прецизионная методика приготовления хромосом-ных диссекционных проб (рис. 8), которая при использовании современных методов много-цветного бэндинга позволяет с высокой точностью и надежностью диагностировать хромо-сомные перестройки, как в клеточных культурах, так и в клетках, полученных непосредствен-но из тканей организма. (Приоритетное направление РАН 6.12.; Программа СО РАН 6.12.1.; ИЦиГ СО РАН).

Рис. 8. Анализ реорганизации хромосомы 9 в эмбриональных стволовых клетках человека: Результаты флуоресцентной гибридизации in situ в варианте многоцветного бэндинга, полученного с использованием микродиссекционных районоспецифичных ДНК-проб хромосомы 9. Нормальный гомолог хромосомы 9 приведен слева, перестроенная хромосома – справа. Приведены профили интенсивностей сигналов флуорохромов и многоцветное окрашивание хромосомных районов, полученное при использовании различных классификаторов псевдоцветов.
Впервые изучены взаимодействия между гомеологичными структурными и регулятор-ными генами в полиплоидных геномах, которые характеризуются дупликацией локусов, на примере четырех генов, кодирующих ключевой фермент биосинтеза флавоноидов растений — флавонон-3-гидроксилазы (F3H). Установлено, что каждый доминантный регуляторный ген Rc-1, контролирующий проявление антоциановой окраски колеоптиля, одинаково влиял на экспрессию трех гомеологичных генов F3H (-A1, -B1, D1), однако уровень экспрессии F3H зависел от присутствующего аллеля Rc-1 (рис. 9). Ген F3H-B2, расположенный в негомеологичный позиции, не экспрессировался. Полученные данные свидетельствует о том, что при дупликации генов в результате объединения нескольких геномов в один, возможна их согласованная работа, которая не приводит к инактивации одной из копий. При дупликации генов в одной хромосоме, происходит инактивация одной из копий. (Приоритетное направление РАН 6.4.; Программа СО РАН 6.4.1.; ИЦиГ СО РАН).
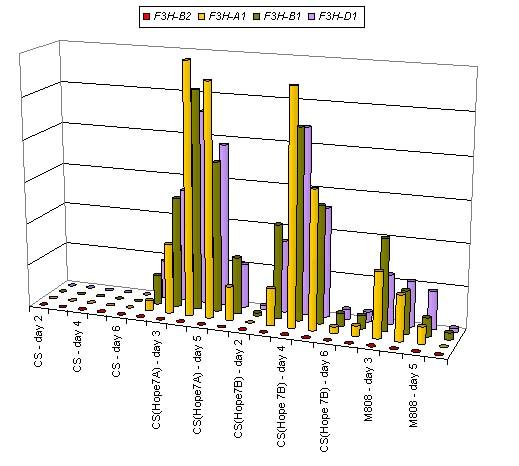
Рис. 9. Количественный ОТ-ПЦР-анализ, проведенный для различных копий флавонон-3-гидроксилазы F3H у сорта ‘Чайниз Спринг’(CS) (антоциановая окраска колеоптиля отсутству-ет) и у сортов c окрашенным колеоптилем (замещенные линии по хромосоме 7А – ‘Чайниз Спринг’/’Хоп’ (‘Hope’ 7A), по хромосоме 7B –‘Чайниз Спринг’/’Хоп’ (‘Hope’ 7B), и ‘Миро-новская 808’(M808)).
Установлено что глюкортикоиды повышают уровень мРНК основной исполнительной протеазы апоптоза каспазы-3 в стволовой части головного мозга (рис. 10; F(2,20) = 3.95, p < 0.05). Это повышение уровня мРНК согласовалось как с иммуногистохимически выявляемым повышением под влиянием глюкокортикоидов уровня белка активной каспазы-3 в стволовой части мозга, так и с интенсификацией под влиянием гормона ключевого признака апоптоза – фрагментации ДНК (F(2,12) = 7.10, p < 0.010). Глюкокортикоиды широко используются в пе-ринатальной медицине с профилактическими целями, поэтому обнаруженная их способность активировать апоптоз в формирующемся головном мозге, свидетельствует о необходимости ограничения назначения этих гормонов лишь по жизненно важным показаниям реальной угрозы проявления респираторного дистресс синдрома новорожденных. (Приоритетное направление РАН 6.11.; Программа СО РАН 6.11.1.; ИЦиГ СО РАН).
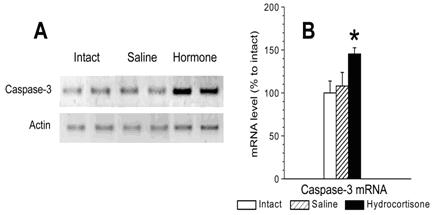
Рис. 10. Уровни мРНК каспазы-3 (А — репрезентативные электрофореграммы продуктов ОТ-ПЦР, В – количественная оценка результатов ОТ-ПЦР), в стволовой части головного мозга 8-дневных крысят через 6 часов после подкожного введения им гидрокортизона (5 мг/кг). Кон-трольных животных оставляли интактными или вводили им эквивалентный объем (20 мкл)физиологического раствора. * p<0,05; по сравнению с контрольными группами. мРНК бета-актина тех же образцов приведены в качестве внутренних стандартов.
Проведен сравнительный анализ влияния мутаций (перекрывающиеся делеции различ-ной длины) в 5’ регуляторной области гена Trithorax-like(Trl), кодирующего фактор транс-крипции GAGA на онтогенез D. melanogaster. Установлено, что фрагмент 5’-области гена Trl размером около 1400 п.о., расположенный выше первого старта транскрипции, необходим для обеспечения правильной экспрессии этого гена в течение всех исследованных нами стадий онтогенеза и во всех проанализированных тканях. Так, было показано, что удаление этого фрагмента драматически сказывается на судьбе питающих клеток и соматических клеток в яйцевых камерах дрозофилы. В тоже время удаление фрагмента 5′- области гена, величиной 96 п.о., где расположены 2 сайта инициации транскрипции у мутантов Trl362(ex), приводит к дефектам в функционировании только отдельных групп соматических клеток — центрипетальных и бордюрных клеток (рис. 11), но этого оказывается достаточно для того, чтобы самки стали стерильными. (Приоритетное направление РАН 6.6.; Программа СО РАН 6.6.1.; ИЦиГ СО РАН).
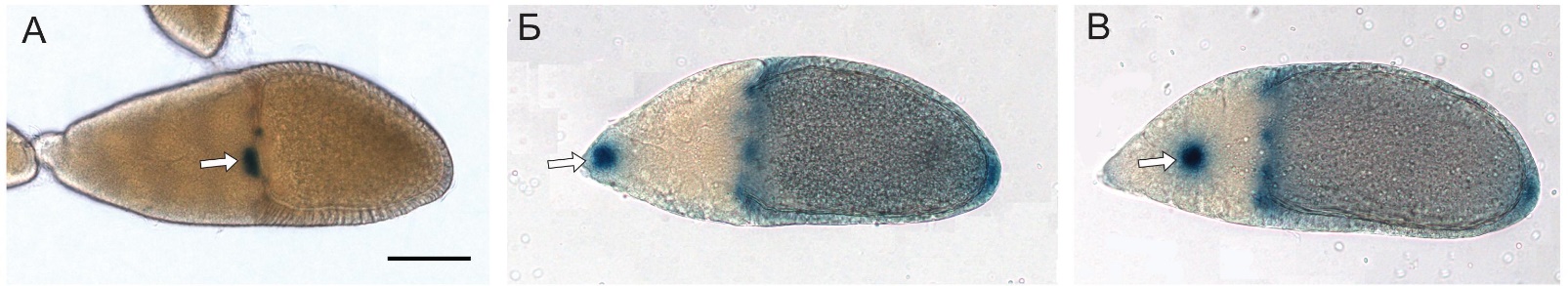
Рис. 11. А – яйцевая камера самок дикого типа, 10 стадия развития. Б, В – яйцевая камера Trl362(ex) мутантов, миграция бордюрных клеток нарушена, поскольку к 10 стадии они не достигли поверхности ооцита. Стрелками указаны бордюрные клетки. Окрашивание с помощью X-Gal
Появление мутаций окраски у пушных зверей в условиях клеточного разведения всегда очень редкое событие, радиационный и химический мутагенез в пушном звероводстве не могут быть использованы. Поэтому нужды мирового рынка пушнины в новых оригинальных окрасках всегда удовлетворялись сохранением и разведением случайно появляющихся в неволе новых аберрантных цветных форм, в большинстве случаев рецессивной природы. Используя эффекты дестабилизирующего отбора Д.К.Беляева, в Институте цитологии и генетики СО РАН разработана технология получения новых окрасочных форм американской норки (рис. 12). Данная технология применима и для других видов пушных зверей, например, собо-лей. (Приоритетное направление РАН 6.3.; Программа СО РАН 6.3.1.; ИЦиГ СО РАН).

Рис. 12. Новые окраски американской норки.
На основе анализа митохондриальных ДНК юкагиров, эвенков и эвенов выявлен и обозначен характерный для юкагиров состав мтДНК-линиджей, отличный от их соседей — чукчей, коряков, тунгусов (эвены и эвенки) и якутов (рис. 13). Полученные материалы положены в основу создания базы данных по вариабельности митохондриальных геномов в полуизолированных популяциях Восточного Приуралья и Сибири. Результаты филогеографического мт-геномов в 22 популяциях коренных жителей Сибири свидетельствуют в пользу эколого-археологической гипотезы, согласно которой первоначальное заселение верхнепалеолитическими охотниками высоких широт Северной Азии имело место до начала последнего ледникового максимума (22 тыс. лет назад). Напротив, юкагиры, связанные культурной преемственностью с неолитическими охотниками на оленя, заселили зону северного леса и тундры Евразии в начале голоцена (~9-10 тыс. лет назад). Получены новые данные по механизмам биологической адаптации человека к Арктике и Субарктике. Для оценки влияния отбора в процессе эволюции митохондриального генома мы использовали тесты Таджимы и Фу. На существенное отклонение от стандартной модели нейтральной эволюции указывают отрицательные величины Fs, найденные у автохтонов кон-тинентальных районов Сибири (юкагиров и тунгусов), сформировавшихся в её южных преде-лах в ледниковое время. (Приоритетное направление РАН 6.12.; Программа СО РАН 6.12.1.; ИЦиГ СО РАН).
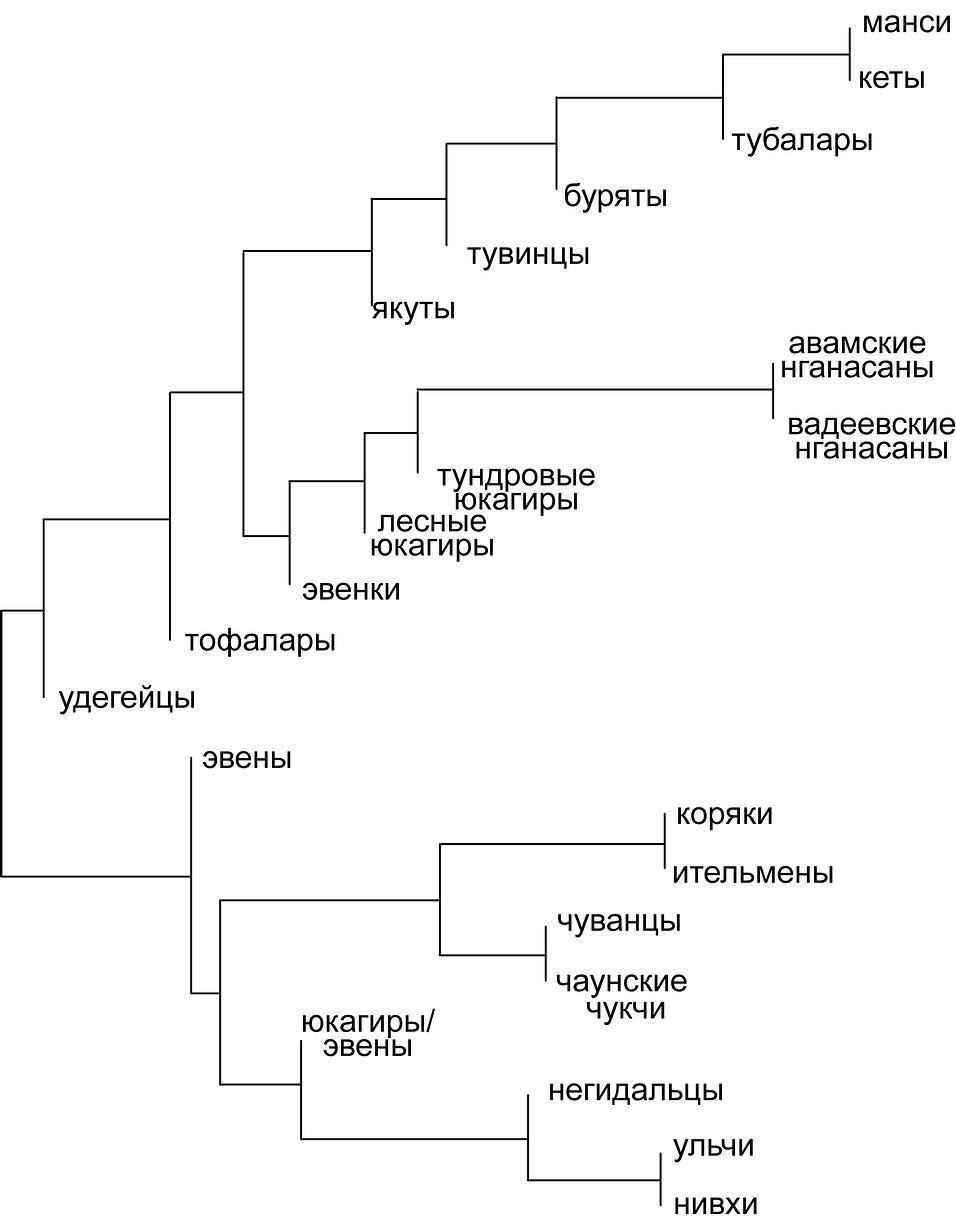
Рис. 13. Филогенетическое дерево сибирских популяций.
Установлены нуклеотидные последовательности для 26-ти яровых и 7-ми озимых об-разцов диплоидных пшениц и 5-ти эгилопсов (рис. 14). Среди 6 проанализированных образцов яровых T. urartu, два, PI428276 и IG-44829, содержали специфическую для А генома встройку размером 8 нп, тогда как ни один из образцов двух других исследованный видов этой встройки не имел. (Приоритетное направление РАН 6.2.; Программа СО РАН 6.2.1.; ИЦиГ СО РАН).
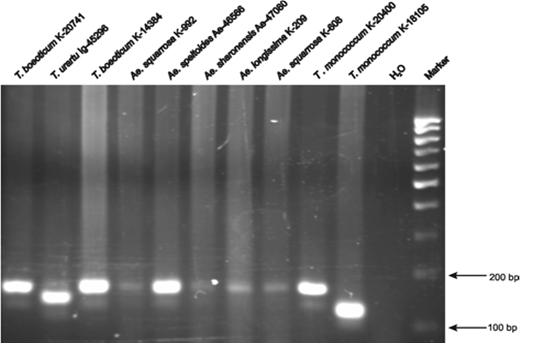
Рис. 14. Электрофорез ПЦР продуктов, полученных в результате амплификации фрагментов промотора Vrn1 гена с праймерами AP1_ProDel_F1/ AP1_ProDel_R1 (Yan et al. 2003) у различ-ных представителей родов Triticum и Aegilops
У голарктических видов рода Chironomus кариофонды популяций в Палеарктике и Не-арктике различались настолько, что популяции с разных континентов можно было считать независимыми видами. Для уточнения степени эволюционной дивергенции палеарктических и неарктических популяций голарктических видов хирономид была оценена степень полиморфизма и дивергенции геномной ДНК в природных популяциях Голарктики у двух видов-двойников — Chironomus plumosus и C. entis. Было показано, что геномная ДНК высокополиморфна во всех изученных популяциях, причём генетические расстояния между популяциями с разных континентов оказались выше, чем между популяциями на каждом из континентов. Сравнение цитогенетических (GDcg) и генетических (GDDNA) расстояний между популяциями обоих видов показало, что их кариофонды и цитогенетическая структура дифференцированы в большей степени, чем геномная ДНК. Однако и цитогенетические, и генетические расстояния между палеарктическими и неарктическими популяциями обоих видов не достигают уровня, характерного для различий между видами (рис. 15). Таким образом, полученные результаты свидетельствуют о том, что дивергенция палеарктических и неарктических популяций C. plumosus и C. entis не завершена и их нельзя рассматривать как независимые виды. (Приоритетное направление РАН 6.3.; Программа СО РАН 6.3.1.; ИЦиГ СО РАН).
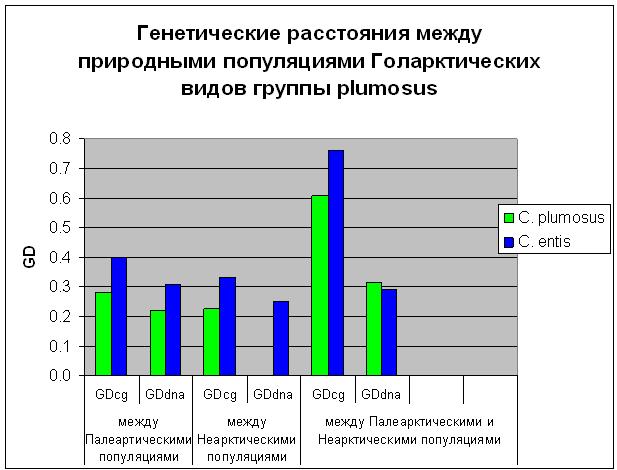
Рис. 15. Генетические расстояния между природными популяциями Голарктических видов рода Chironomus группы plumosus.