2003 год
Важнейшие результаты 2003 год
1. ИЛЛЮСТРАТИВНОЕ КРАТКОЕ ИЗЛОЖЕНИЕ ВАЖНЕЙШИХ РЕЗУЛЬТАТОВ ЗАВЕРШЕННЫХ ФУНДАМЕНТАЛЬНЫХ ИССЛЕДОВАНИЙ
С помощью метода хромосомной живописи (painting) проведено детальное сравнение геномов человека и трех видов древнейшей ветви плацентарных млекопитающих, Afrotheria (индийского и африканского слонов и трубкозуба). Пробы всех хромосом человека, африканского слона и трубкозуба получены при хромосомном сортинге и использованы для реципрокного пэйнтига на хромосомы этих видов и индийского слона, что позволило включить древнейший надотряд млекопитающих в группу видов с известной структурой геномов (рис. 1). Показано, что трубкозуб имеет геном, по своей структуре, наиболее близкий к структуре генома предполагаемого предка млекопитающих.
Открыт новый ген SuUR, который задействован в управлении репликацией ДНК в районах интеркалярного гетерохроматина. В мутантах по исследуемому гену эти районы не только заканчивают репликацию раньше нормы, но и политенизируются полностью. Исследована эктопическая экспрессия гена SuUR в системе GAL4-UAS (рис. 2). Установлено, что проявление эктопической экспрессии различается в политенных и диплоидных тканях. Эффект эктопической экспрессии SuUR усиливается при мутации в генах E2F и mus209. Разница в проявлении эктопической экспрессии SuUR в полиплоидных и диплоидных тканях, вероятно, отражает механизм, лежащий в основе клеточного цикла и эндоцикла.
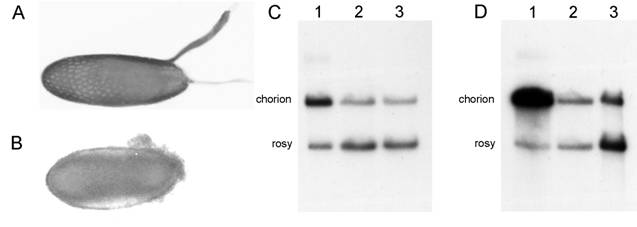
Рис. 2. Картина подавления амплификации хорионовых генов при эктопической экспрессии конструкции UAS-SuUR в фолликулярных клетках. показаны нормальные эмбрионы (A) и дехорионизированные эмбрионы (B) линии с323>UAS-SuUR. Приведена картина количественного Саузерн-блот на стадии 10В (C): ДНК из фолликулярных клеток самок линии Oregon-R (1) , ДНК из фолликулярных клеток самок линии c323>UAS-SuUR (2) , ДНК имагинальных дисков линии Oregon-R (3) . Аналогичный анализ проведен для фолликулярных клеток на более поздней стадии 11-14 (D) . Chorion — фрагмент хорионового гена Cp15. Rosy — фрагмент гена rosy как контроль.
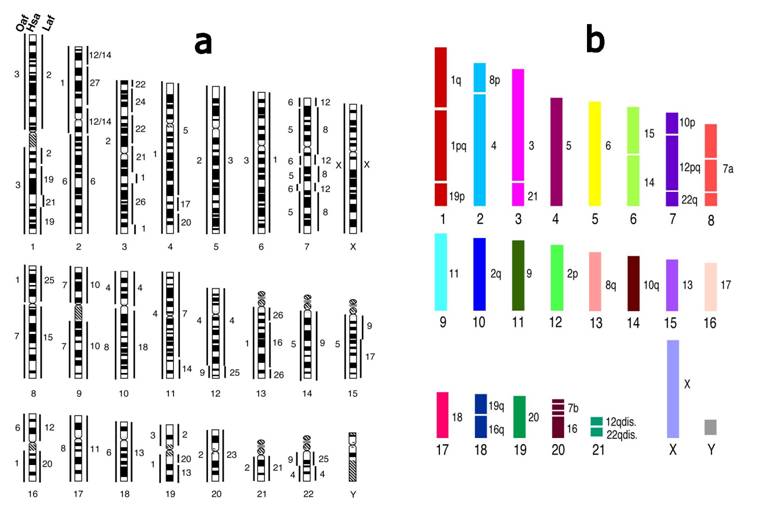
Рис. 1. Сравнение геномов человека и трех видов древнейшей ветви плацентарных млекопитающих, Afrotheria (индийского и африканского слонов и трубкозуба). a — карта хромосом человека с локализацией на них проб хромосом африканского слона (LAF) и трубкозуба (OAF); b — предполагаемая нами карта генома предка млекопитающих, вычисленная в результате сравнения геномов более 70 видов из различных отрядов млекопитающих и оказавшаяся весьма близкая таковой у трубкозуба.
Создан молекулярный вектор pBi101-IL18 с геном, кодирующим зрелую форму интерлейкина-18 человека (IL18). Методом агробактериального переноса получены трансгенные растения табака, среди которых отобрано 6 моноинсерционных форм. Наличие последовательности IL18 подтверждали ПЦР анализом и методом Саузерн блот гибридизации (рис. 3А). Уровень экспрессии белка на основании результатов Вестерн-блота в тканях трансгенных растений табака составил более 0.01% общего растворимого белка (рис. 3Б). Полученные растения могут являться эффективным продуцентом интерлейкина-18 человека, используемого в качестве иммуномодулятора в медицине.
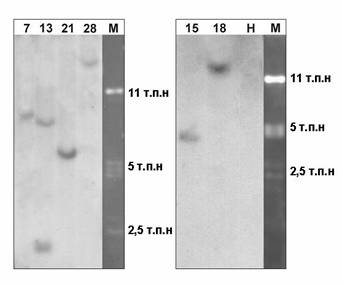
Рис. 3А: Блот-гибридизация геномных ДНК у отобранных трансгенных растений табака с 32Р меченным фрагментом кДНК гена ИЛ-18 человека: на дорожках 7-28 нанесены HindIII гидролизаты геномных ДНК растений с соответствующими номерами; Н — HindIII гидролизат ДНК нетрансгенного растения табака; М — PstI фрагменты ДНК фага гамма.
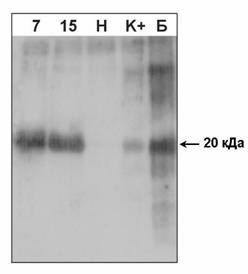
Рис. 3Б: Результаты Вестерн-блот анализа трансгенных растений табака; 7 и 15 — белковые экстракты из трансгенных растений №7 и №15; Н — белковый экстракт из нетрансгенного растения; К+ — белковый экстракт из нетрансгенного растения с добавленным рекомбинантным ИЛ-18 человека из клеток E. coli до концентрации 0,01% общего растворимого белка; Б -рекомбинантный ИЛ-18 человека из клеток E.coli.
Впервые получены трофобластные стволовые (ТС) клеточные линии обыкновенной полевки. До настоящего времени у млекопитающих ТС клеточные линии были получены только у мыши. Наличие ТС клеточных линий, которые могут дифференцироваться in vitro в трофобластные типы клеток, открывает новые возможности для выяснения функции и регуляции экспрессии генов, важных для развития трофобластной линии у млекопитающих, а также представляет новую модельную систему in vitro для изучения импринтированной инактивации Х-хромосомы. Две независимые ТС клеточные линии были получены из бластоцист обыкновенной полевки M. rossiaemeridionalis с использованием полевочьего фактора LIF, ингибирующего дифференцировку, и питающего (фидерного) слоя клеток. Полученные линии клеток быстро растут, что является характерной чертой эмбриональных стволовых клеток, образуют плоские колонии, похожие на ТС-колонии мыши (рис. 4). Полученные линии стабильно сохраняют фенотип на протяжении уже 40 пассажей, уровень спонтанной дифференцировки клеток составляет 5-10%, при этом основной тип дифференцированных клеток — гигантские клетки трофобласта. Цитогенетический анализ показал, что обе клеточные линии имеют диплоидный набор аутосом, половые хромосомы XY и XO. В полученных клеточных линиях выявлена экспрессия генов Errb, Fger2 и Cdx2, характерных для ТС-клеток мыши.
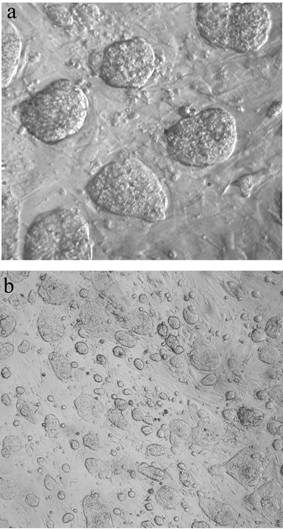
Рис. 4. Колонии клеток трофобластной стволовой (ТС) линии M. rossiaemeridionalis на фидерном слое первичных эмбриональных фибробластов мыши. a — увел.: об.х10, ок.х4 b — увел.: об.х2.5, ок.х4.
Выявлены функционально-значимые сайты во втором интроне гена Trihtorax-like Drosophila melanogaster (Trl), продукт которого является транскрипционным фактором GAGA и необходим для осуществления многих процессов, таких как регуляция экспрессии генов, формирование клеточной памяти и деление клеточных ядер. Вывод получен на основе серии делеций, удаляющих различные области второго интрона гена Trl. Показано, что удаление участков второго интрона приводит к снижению жизнеспособности мутантов. В частности, удаление фрагмента величиной 700 п.о. (Df72) в 3′ области второго интрона приводит к десятикратному снижению жизнеспособности мутантов при 29OС (рис. 5). У мутантов Df72. выявлено также изменение экспрессии гена Trl. В данном районе имеются сайты гиперчуствительности к эндонуклеазам и эволюционно-консервативные блоки ДНК, что тоже может свидетельствовать о наличии функционально-значимых сайтов в этом районе.
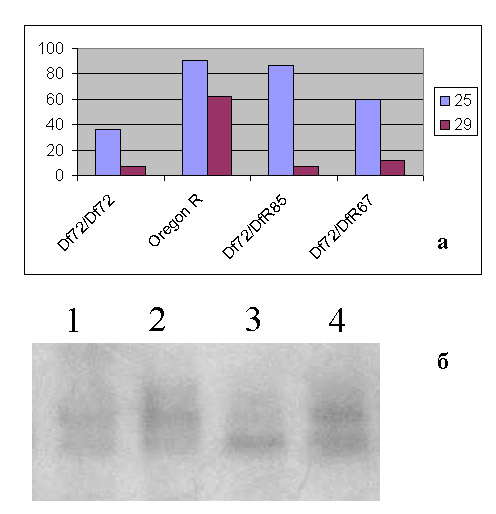
Рис 5. а) Жизнеспособность мутантных гомозигот Df72/Df72 и гетерозигот Df72/нуль-аллелей гена Trl (R85 и R67) при различных температурах. Дикая линия Oregon R использовалась в качестве контроля. б) нозерн блот анализ транскрипции гена Trl при различных температурах. Суммарная РНК выделена из эмбрионов мутантной линии (Df72) и дикого типа (Oregon R): 1 — Df72/72, 25 C; 2 — Oregon R, 25 C; 3 — Df72/72, 29 C; 4 — Oregon R, 29 C.
Впервые обнаружена необычно высокая ассоциация инфаркта миокарда с полиморфизмом V64I гена, кодирующего хемокиновый рецептор CCR2, который является одним из ключевых регуляторов воспаления (рис. 6). Носителями аллеля 64I являлись более чем 60% больных, в то время как частота соответствующих генотипов в контрольной популяции составляет только 12%. Относительный риск инфаркта миокарда для генотипов, имеющих аллель 64I, намного превосходит таковой для всех описанных ранее полиморфизмов генов предрасположенности к инфаркту миокарда. Ассоциация полиморфизма V64I гена CCR2 с инфарктом миокарда впоследствии была независимо подтверждена зарубежными исследователями на популяциях немцев и чехов.
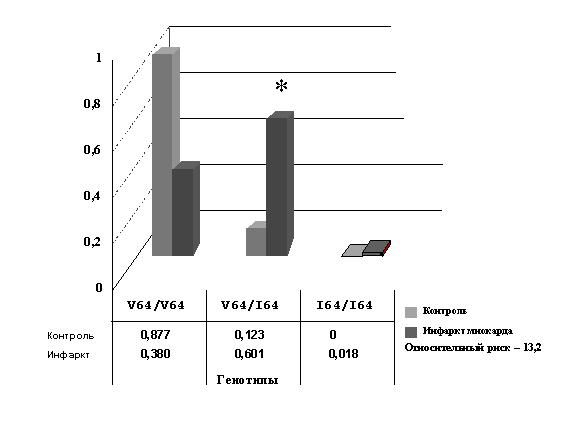
Рис. 6. Ассоциация полиморфизма V64I гена хемокинового рецептора CCR2 c инфарктом миокарда в популяции русских г. Новосибирска.
С помощью in situ гибридизации с использованием ВАС клонов человека, исследован консервативный район, представленный у человека хромосомой 17, свиньи — хромосомой 12, американской норки — 5q, иберийской бурозубки — хромосомой h и лисицы — районами хромосом 2 и 12. Установлено, что в терминальном районе р плеча хромосомы 17 человека наблюдается инвертированный порядок локусов по сравнению с таковым у свиньи, американской норки и иберийской бурозубки (рис. 7). Предполагается, что эта инверсия является эволюционным приобретением генома человека. Кроме того, в h хромосоме иберийской бурозубки выявлено изменение позиции локуса, гомеологичного ВАС клону 321G8 по сравнению с его позицией у человека.
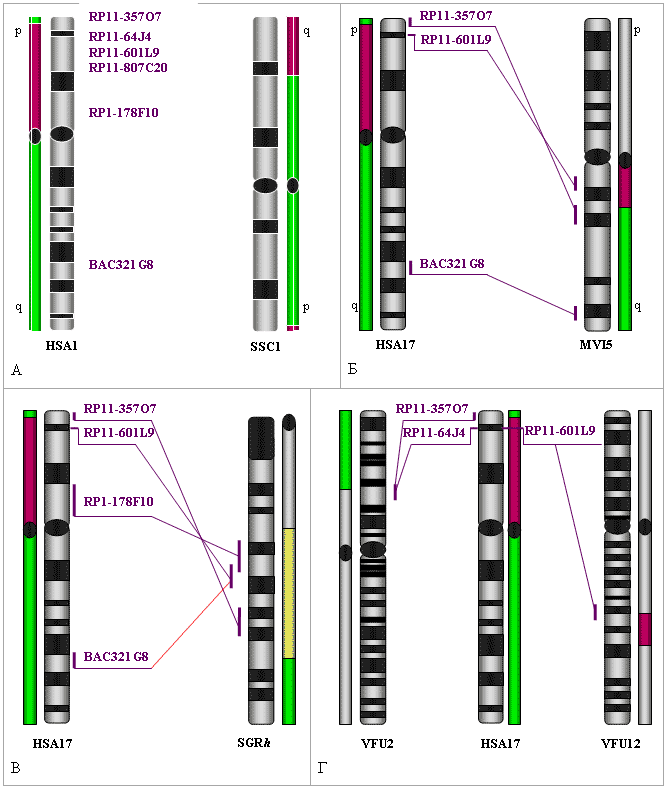
Рис. 7. Сравнение положения гомеологичных локусов в хромосомах человека (HSA17) и: (А) — свиньи (SSC12), (Б) — американской норки (MVI5), (В) — иберийской бурозубки (SGR h), (Г) — серебристо-чёрной лисицы (VFU2 и VFU12). Красным и зелёным цветом обозначены районы гомеологии, установленные с помощью региональных микробиблиотек, жёлтым — с помощью хромосомоспецифичной пробы человека.
Разработана база данных TRRD, предназначенная для описания структурно-функциональной организации регуляторных районов генов человека, животных, растений и микроорганизмов на основе аннотации экспериментальных данных, представленных в научных публикациях. TRRD является уникальным интегрированным ресурсом, включающим широкий спектр данных как об иерархической организации транскрипционных регуляторных районов генов эукариот, так и о функциональных характеристиках регуляторных элементов каждого уровня. Текущая версия TRRD содержит данные о 2186 генах, 3254 регуляторных единицах 9480 сайтах связывания транскрипционных факторов, 14 LCR, 13173 паттернах экспрессии. В каждом входе TRRD, соответствующем одному гену, одновременно представлена информация, полученная при изучении протяженных регуляторных районов, сайтов связывания транскрипционных факторов, а также особенностей экспрессии данного гена. TRRD включает также сведения о структурно-функциональных характеристиках LCR. На рис. 8 представлена схема регуляторных районов гена apo(a) человека, построенная на основе информации об этом гене, собранной в TRRD.
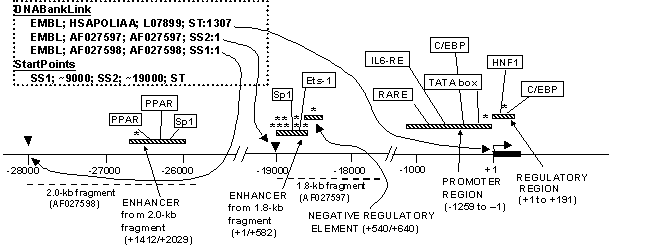
Рис. 8. Организация регуляторных районов, контролирующих транскрипцию гена аполипопротеина (а) человека. Схема построена на основе информации из базы данных TRRD/ Прямоугольники с диагональной штриховкой — регуляторные единицы. Звездочками обозначены сайты связывания белков неизвестной природы, которые внесены в TRRDSITES на основании экспериментов по футпринтингу (DNaseI protection analysis). Позиция «+1» соответствует старту транскрипции (ST) гена apo(a). Черный прямоугольник — экзон 1. Черными треугольниками обозначены точки отсчета SS1 и SS2, которые в представленном примере соответствуют первым нуклеотидам фрагментов длиной 2.0 и 1.8 kb, представленных в EMBL Nucleotide Sequence Database (Acc. Ns AF027597, AF027598). Пунктирной штриховкой обозначены участки, соответствующие 2.0 и 1.8 kb фрагментам, представленным в EMBL Nucleotide Sequence Database (Acc. Ns AF027597 AF027598). В прямоугольнике, ограниченном пунктирной линией, приведены фрагменты записи из TRRDGENES, содержащие позиции точек отсчета в соответствующих входах из EMBL Nucleotide Sequence Database и относительное расположение точек отсчета.
Идентифицирован ранее неизвестный рецептор цитотоксических клеток иммунной системы человека. Рецептор, названный IFGP6, принадлежит IFGP/IRTA/FcRH семейству FcR-подобных белков, отличается уникальной доменным составом и содержит два ITIM мотива во внутриклеточной области (рис. 9). В отличие от остальных членов семейства, экспрессирующихся в В клетках, IFGP6 является маркером CD8+Т клеток памяти и покоящихся NK клеток. Уровень экспрессии гена IFGP6 является чувствительным индикатором различного рода дисбалансов иммунной системы.
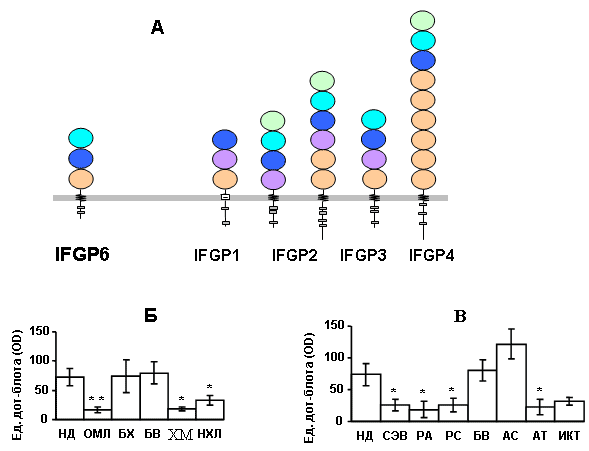
Рис. 9. Доменная архитектура нового рецептора IFGP семейства FcR-подобных белков (А). На диаграммах приведено сравнение экспрессии гена в CD8+ Т лимфоцитах в норме и при различных заболеваниях человека с помощью дот-гибридизации на чипах Blood disease рrofiling array и Autoimmune disease рrofiling array (Clontech), соответственно. На чипе Blood disease рrofiling array (Б) представлены клетки здоровых доноров (НД), доноров с острой миелоидной лейкемией (ОМЛ), болезнью Ходчкина (БХ), хронической миелоидной лейкемией (ХМЛ), неходчкинскими лимфомами (НХЛ). На чипе Autoimmune disease profiling array (В) — клетки от доноров с системной эритроматоидной волчанкой (СЭВ), ревматоидным артритом (РА), рассеянным склерозом (РС), антифосфолипидным синдромом (АС), артериитом Такаясу (АТ), идиопатической красной тромбоцитопенией (ИКТ). В качестве контрольного заболевания, не связанного с иммунной системой, на обоих чипах представлены клетки доноров с болезнью Виллебранда (БВ). Двумя звездочками обозначена 99% достоверность различия доноров, пораженных болезнью по сравнению с нормой, одной звездочкой — 95%.
Впервые проведено генотипирование 54 современных и стародавних отечественных сортов мягкой пшеницы с использованием 23 микросателлитных маркеров. Показано, что в основном все сорта разделяются на 2 примерно равных кластера: один из них (в дендрограмме на рис. 10 — верхний) включает преимущественно стародавние сорта, тогда как другой кластер содержит, главным образом, современные сорта («Омская 9», «Сибаковская 3» и т.д.), разработанные после 1960 г. Составлен микросателлитный паспорт гипотетического «среднeго» генотипa современного российского сорта, который практически полностью соответствует результатам геномной дактилоскопии сорта «Саратовская 29».
У посевного гороха индуцирована гамма-излучением новая гомеозисная мутация tl2, представляющая уникальный случай межаллельного взаимодействия — мутантный фенотип проявляется только в гетерозиготе с нормальным аллелем. Мутация затрагивает превращение листочек-усик и локализована в коротком плече хромосомы 6. Гетерозиготы tl2/+ имеют аномальные усики с узкой ламиной (рис. 11), однако у гомозигот tl2/tl2 усики нормальные. У трисомиков с генотипами tl2/+/+ или tl2/tl2/+ усики аномальные, тогда как у гомозигот tl2/tl2/tl2 — нормальные. По-видимому, для нарушения развития усиков необходимо взаимодействие продуктов нормального и мутантного аллелей.

Рис. 11. Фенотип гетерозиготы tl2/+ у гороха: плоские усики. Слева — молодой лист, в середине — зрелый лист, справа — дистальная часть зрелого листа.
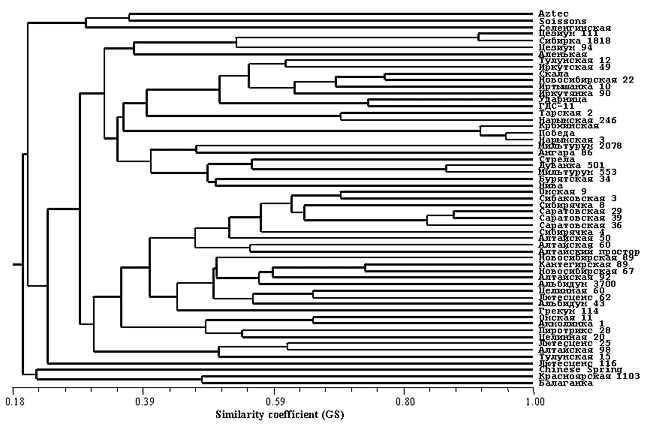
Рис. 10. Дендрограмма, отражающая генетическое сходство между 54 генотипами мягкой пшеницы, построенная на основе анализа 23 микросателлитных локусов. Сорта «Chinese Spring», «Aztec» и «Soissons» использовались в качестве контроля.
Методом компьютерной морфометрии, на изолированных собирательных трубках почки крыс исследована вазопрессин-зависимая осмотическая проницаемость (Pf) базолатеральных клеточных мембран. Впервые показано, что водная проницаемость базолатеральных мембран нарастает у животных при повышении уровня эндогенного вазопрессина в результате дегидратации. Pf существенно нарастает при кратковременном действии агониста рецепторов вазопрессина V2 типа (dDAVP). Хлорная ртуть обратимо подавляет стимулированный вазопрессином перенос воды через базолатеральную мембрану, что указывает на участие в транспорте воды ртуть-чувствительных аквапоринов (вероятнее всего AQP3). Для объяснения повышенной водной проницаемости у дегидратированных животных наиболее вероятной представляется гипотеза об увеличении синтеза аквапоринов de novo, о чем свидетельствуют активация экспрессии генов рецептора вазопрессина V2 и аквапоринов 2, 3 и 4 типов (рис. 12). Таким образом показано, что вазопрессин оказывает длительный эффект на проницаемость базолатеральной мембраны главных клеток эпителия собирательных трубок путем активации биосинтеза AQP3 и AQP4. Быстрый эффект гормона осуществляется с V2 рецепторов через систему пока не установленных вторичных посредников.
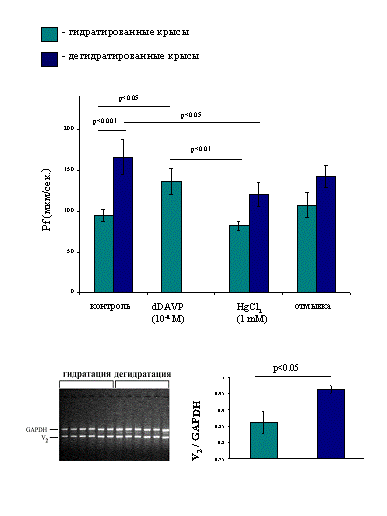
Рис. 12. Влияние водной депривации и десмопрессина на водную проницаемость и экспрессию генов водных каналов базолатеральной мембраны собирательных трубок почки крысы.
Впервые установлено, что временное выключение экспрессии гена альфа2А-адренорецептора в области скопления тел норадренергических нейронов головного мозга путем введения олигонуклеотида комплементарного транскрипту гена (антисенс-нокдаун) в критический период раннего онтогенеза сопровождается снижением функции надпочечников, оцененной по уровню кортикостерона в крови в ювенильном и препубертатном возрасте (рис. 13). Этот эффект специфичен для этой эндокринной системы поскольку показатели функциональной активности семенников не менялись.
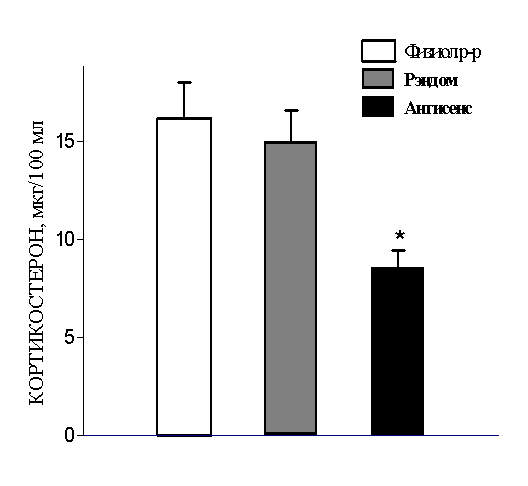
Pис. 13. Уровень кортикостерона в крови ювинильных крыс (24-дневных) после кратковременного подавления экспрессии альфа2А-адренергического рецептора в их головном мозгу антисенсом в первые дни жизни. Вещества, введенные в мозг на 2-4 дни жизни: физиол. р-р — физиологический раствор; Рэндом — олигонуклеотид случайной последовательности; Антисенс — олигонуклеотид комплементарный участку -11 — +7 транскрипта гена альфа2А-адренорецептора. * р<0.05 по сравнению с контрольными группами.
Установлено, что мыши с генетическим нокаутом МАО А отличаются от мышей дикого типа сниженной реакцией гипоталамо-гипофизарно-надпочечниковой системы на различные виды острого стресса (холодовой, эмоциональный, водная депривация) и хронический стресс (рис. 14).
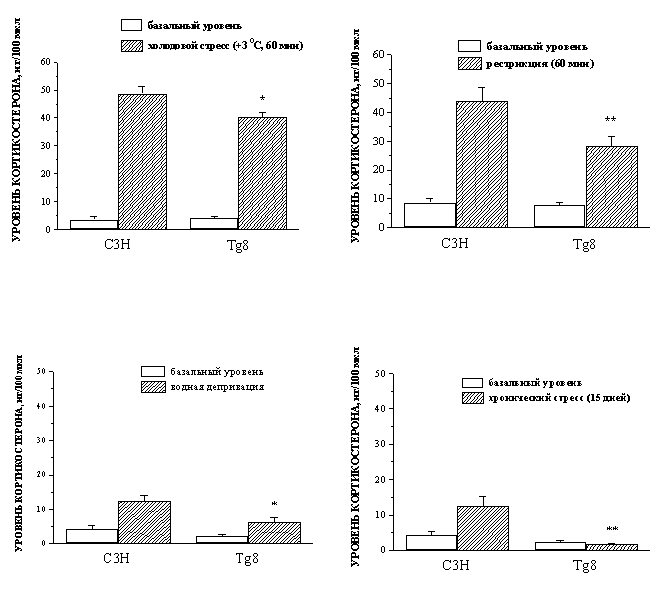
Рис. 14. Влияние острого стресса (холодовой, рестрикция, водная депривация) и хронического стресса на уровень кортикостерона в плазме у мышей C3H и Tg8.
* p < 0,05; ** p < 0,01 по сравнению с С3Н.
Установлено, что генетически обусловленное повышение стресс-реактивности может быть исходной причиной развития стойкой артериальной гипертензии (рис. 15). В основе патогенеза стресс-зависимой артериальной гипертонии лежит повышение симпатической активности. На первых этапах гипертония носит пограничный характер, в последствии с развитием процессов ремоделирования сердца и сосудов и с вовлечением почечных механизмов повышения АД развитие гипертензивного статуса становится практически необратимым. Специфические фармакологические воздействия и мягкий эмоциональный стресс в раннем постнатальном онтогенезе способны уменьшить проявления гипертензивного статуса во взрослом состоянии. Генетическая предрасположенность к усилению стрессовых реакций, которая проявляется не только в виде повышения АД, но и на уровне поведенческих и эндокринных реакций, связана с полиморфизмом локуса маркирующего ген рецептора фактора роста нервов (Ngfr ). На последующих этапах онтогенетического развития гипертензивного статуса обнаруживается также его ассоциация с полиморфизмом локуса K,Na-ATФазы.
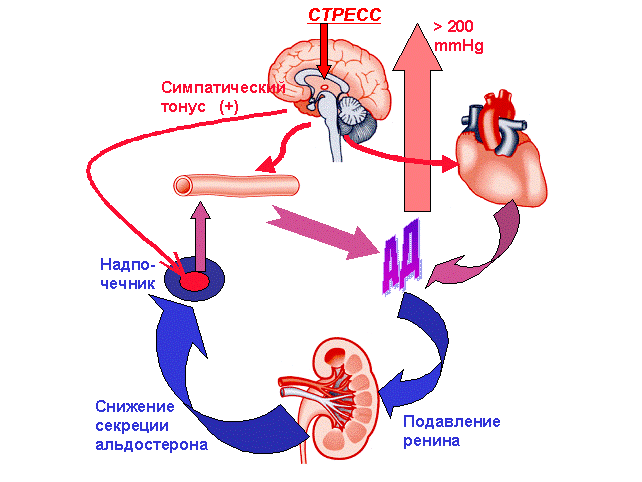
Рис. 15. Физиологические механизмы стресс-чувствительной гипертонии у крыс линии НИСАГ (начало формирования).
Одомашнивание диких животных, первым этапом которого является их интродукция в условия неволи, сопряжено с адаптацией к комплексу новых для вида факторов, главным из которых выступает сам человек. Весьма распространенным типом контактов человека и животных является хэндлинг (взятие на руки), который является психологическим стрессором. Нами впервые установлены значительные изменения в гипофизарно-адренокортикальной системе у щенков песцов в фетальный и неонатальный периоды развития, если их матери подвергались хэндлингу в период беременности. Кроме того, установлено, что у пренатально стрессированных щенков большинство гормональных и морфометрических параметров ГГНС нормализовалось в ювенильный период, однако было обнаружено снижение уровня кортизола и прогестерона в периферической крови (рис. 16). Выявленные изменения в эндокринном развитии ГГНС у ювенильных песцов под влиянием пренатального стресса, предполагают снижение реакции ГГНС на стрессорные воздействия.

Рис. 16. Уровень кортизола и прогестерона в плазме периферической крови у пренатально стрессированных песцов в препебертатный период. * Достоверность различий между контролем и опытом (P<0.05). Количество животных в группе варьировало от 22 до 27 особей.