2009 год
ажнейшие результаты 2009 год
ИЛЛЮСТРАТИВНОЕ КРАТКОЕ ИЗЛОЖЕНИЕ ВАЖНЕЙШИХ РЕЗУЛЬТАТОВ ЗАВЕРШЕННЫХ ФУНДАМЕНТАЛЬНЫХ ИССЛЕДОВАНИЙ
На основе разработанных методов хромосомной инженерии созданы иммунные линии сорта мягкой пшеницы Саратовская 29: от дикорастущих сородичей пшеницы – T.timopheevii и T.tauschii в геном этого сорта интрогрессированы гены, контролирующие комплексную устойчивость растений к грибным патогенам и высокое содержание белка в зерне. Показана перспективность использования иммунных линий в селекционных программах: в совместной работе с СИБНИИСХ СО РАСХН (г. Омск) создан сорт яровой мягкой пшеницы Памяти Майстренко (селекционный номер Лютесценс 23528), который передается на государственное сортоиспытание (Рис. 1) (Приоритетное направление РАН 6.4.; Программа СО РАН 6.4.1.; ИЦиГ СО РАН, д.б.н. Першина Л.А.).

Рис. 1. Колосья (1) и хлебцы сорта мягкой пшеницы Памяти Майстренко (2a); 2б – стандарт (сорт мягкой пшеницы Омская 35).
При изучении причин и механизмов формирования наследственно обусловленной стресс зависимой формы артериальной гипертонии (эксперименты проведены на крысах линии НИСАГ) был идентифицирован генетический локус на 8-ой хромосоме крысы, ответственный за различия между гипер- и нормотензивными крысами по уровню дофамина в продолговатом мозге (Рис. 2) Дофамин в качестве нейромедиатора центральной нервной системы играет важную роль в регуляции многих физиологических функций, в том числе и артериального давления. Именно в этом отделе мозга расположены центры регуляции сосудистого тонуса и артериального давления. Это исследование открывает новые перспективы для выяснения генетико-физиологических механизмов артериальной гипертонии. (Приоритетное направление РАН 6.12.; Программа СО РАН 6.12.1.; ИЦиГ СО РАН, д.б.н. Маркель А.Л.).
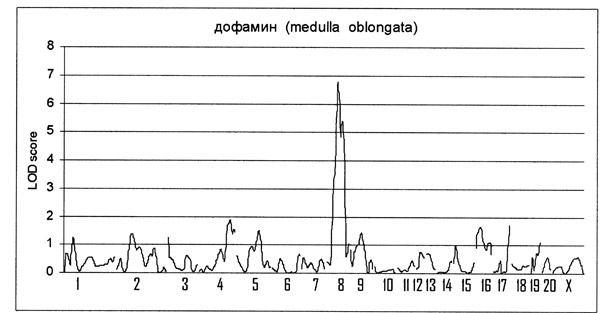
Рис. 2. График вероятностей ассоциации генетических локусов на хромосомах крысы (номера хромосом обозначены на горизонтальной оси) с особенностями концентрации дофамина в продолговатом мозге у крыс линии НИСАГ.
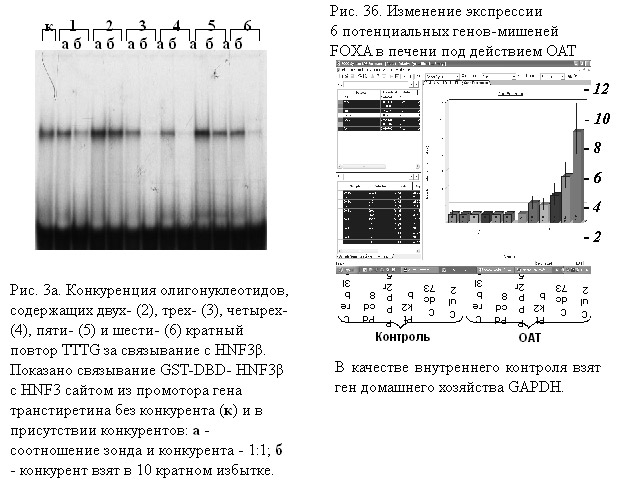
С помощью компьютерного метода распознавания сайтов связывания транскрипционных факторов семейства HNF3, разработанного на основе программного пакета SITECON, выявлен новый тип сайтов связывания этих белков – микросаттелитный повтор TTTG (от трех до шести звеньев). С использованием олигонуклеотидов, соответствующих сайтам с разным числом копий TTTG, и GST-слитых белков, содержащих ДНК-связывающие домены HNF3? и HNF3?, показано, что для эффективного связывания микросаттелитов необходимо не менее трех звеньев TTTG (Рис. 3а). Методом ПЦР в реальном времени исследовано влияние аминоазокрасителя ОАТ, который приводит к снижению активности HNF3 в печени мыши, на экспрессию 6-и генов, содержащих микросаттелитные сайты (Рис. 3б). Показано, что под действием ОАТ возрастает уровень мРНК 5-и генов, что указывает на функциональную значимость найденного нами нового типа сайтов связывания HNF3 белков. (Приоритетное направление РАН 6.6.; Программа СО РАН 6.6.1.; ИЦиГ СО РАН, д.б.н. Меркулова Т.И.).
В опытах крысах линии Браттлборо с генетически обусловленным дефектом синтеза нейрогипофизарного гормона вазопрессина установлена регрессия опухоли, формирующейся после инокуляции клеток карциносаркомы Walker 256 (Рис. 4). В то же время у нормальных крыс WAG опухоль прогрессивно растет и приводит животных к гибели на 25-28 день. Повышение уровня вазопрессина в крови крыс Браттлборо с помощью имплантированной минипомпы, содержащей гормон, сопровождается активацией роста опухоли, на первоначальной стадии, но не отменяет ее регрессии. Эта генетическая модель представляется перспективной для выявления эндогенных факторов, тормозящих канцерогенез. (Приоритетное направление РАН 6.11.; Программа СО РАН 6.11.1.; ИЦиГ СО РАН, академик Иванова Л.Н.).
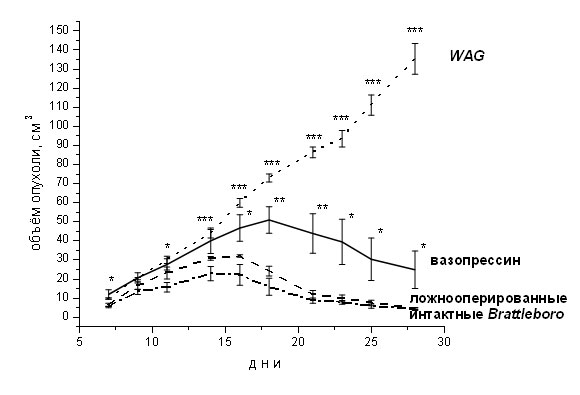
Рис. 4. Динамика роста опухоли Walker 256 у крыс нормальной линии WAG и вазопрессин-дефицитных крыс Браттлборо (интактных, ложнооперированных и длительно инъецированных вазопрессином через минипомпу). Достоверность отличия от интактных крыс Brattleboro, * – р < 0.05, ** – р < 0.01, *** — p < 0.001.
При анализе механизмов развития депрессии и действия антидепрессантов впервые обнаружено повышение флюоксетином экспрессии ключевого фермента синтеза нейротрансмиттера серотонина — триптофангидроксилазы-2 (ТПГ2) — в головном мозге, которое коррелировало с проявлением антидепрессантного действия препарата (Рис. 5). Результат выявил новую потенциальную мишень — ТПГ2, для терапии псиоэмоциональных расстройств и указал на одну из причин задержки терапевтического эффекта совремеменных антидепрессантных препаратов, таких как флюоксетин, механизм действия которых связан с блокадой удаления нейромедиатора серотонина из синапса. (Приоритетное направление РАН 6.11.; Программа СО РАН 6.11.1.; ИЦиГ СО РАН, д.б.н. Дыгало Н.Н.).
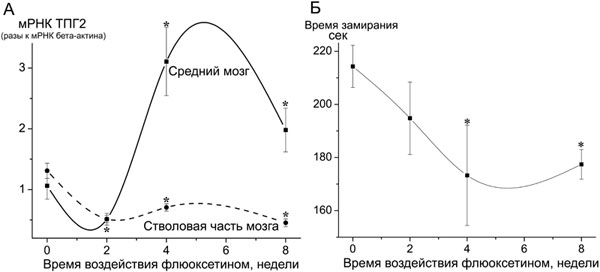
Рис. 5. Специфическое повышение экспрессии ТПГ2 в среднем мозге после потребления антидепрессанта флюксетина (А) сопровождается одновременным снижением депрессивно-подобного поведения животных в тесте вынужденного плавания — проявлением антидепрессантного эффекта препарата (Б). *- достоверные отличия от крыс, которые не потребляли антидепрессант (0-недель воздействия флюоксетином).
Ключевым этапом изучения структурной организации теломерных/субтеломерных участков хромосом является анализ протяженных участков ДНК из этих районов в составе вектора ВАС (bacterial artificial chromosome). Впервые показано, что субтеломерные повторы Spelt1 и Spelt52 являются эффективными маркерами для отбора последовательностей, локализующихся на концах хромосом различных видов пшениц, из геномных ВАС-библиотек (рис.6 а,б). Анализ первичной структуры одной из отобранных последовательностей (ВАС_2050O8), локализованной на конце длинного плеча хромосомы 4B мягкой пшеницы, показал, что в ее составе преобладают ДНК-транспозоны (24,6% от всей длины последовательности), и наблюдается низкое содержание ретроэлементов (8,4%) и генов (6,1%) (рис. 6в). Впервые показано, что характерной компонентой субтеломерных районов хромосом диплоидных и полиплоидных видов Triticum и Aegilops являются ДНК-транспозоны семейства Caspar. (Приоритетное направление РАН 6.4.; Программа СО РАН 6.4.1.; ИЦиГ СО РАН, д.б.н. Салина Е.А.).

Рис. 6. Локализация ВАС_2050О8 (зеленый цвет) на хромосомы мягкой пшеницы Triticum aestivum (а) и Triticum monococcum (б). Идентификация хромосом проводилась согласно расположению маркера pSc119.2 (красный цвет). (в) Структура ВАС_2050О8 длиной 119737 п.н. Указано расположение и содержание мобильных элементов, повторяющихся последовательностей Spelt52 и генов.
Создана математическая модель распределения ауксина вдоль корня и регуляции положения стволовых клеток в его кончике (Рис. 7А). В модели, описываемой системой обыкновенных дифференциальных уравнений, учитываются (А) активный транспорт ауксина, его диффузия, деградация и поступления ауксина из побега; (Б) отрицательная и положительная обратные связи от ауксина на скорость его активного транспорта через белок PIN1. Согласно результатам моделирования (В), максимум концентрации ауксина совпадает с положением стволовых клеток в кончике корня и сохраняет свое положение при делении и росте клеток, что согласуется с экспериментальными данными (Г). Кроме того, наблюдалось стационарное увеличение концентрации ауксина в центральной части корня и у его основания (Г), что соответствует зонам формирования боковых и придаточных корней. Таким образом, модель объясняет механизмы формирования двух основных типов корневой системы растений: стержневой или мочковатой (Д), что имеет большое значение для планирования генноинженерных экспериментов по созданию новых форм растений с заданными морфотипами. (Приоритетное направление РАН 6.9.; Программа СО РАН 6.9.1.; ИЦиГ СО РАН, академик Колчанов Н.А.).
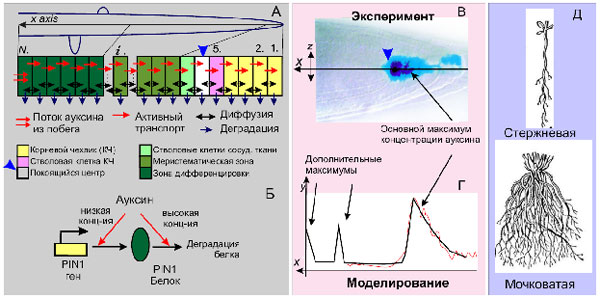
Рис. 7. Моделирование распределения ауксина в корне растения. А. Типы клеток, расположенные вдоль центральной оси x корня и процессы, влияющие на распределение ауксина. Б. Генетическая регуляция ауксином экспрессии PIN1 гена, кодирующего белок – транспортер ауксина. В. Экспериментальные данные о распределении ауксина в кончике корня растений (Sabatini et al., 1999). Г. Соответствие результатов моделирования (черная кривая) экспериментально наблюдаемому распределению ауксина в кончике корня (красная кривая). Д. Разные типы корневых систем растений: стрежневая и мочковатая.
Совместно с Медицинским центром Эразмус (Роттердам, Голландия) ведется картирование генов роста человека. Проведен подробный анализ дистального района хромосомы 16, где ранее был обнаружен максимальный пик сцепления. В районе этого пика, на участке длиной 10 миллионов пар оснований (Mb) было генотипировано 11840 дополнительных маркеров (Рис. 8). 19 из них продемонстрировали достоверную ассоциацию с ростом человека. Все они были локализованы в районе гена кадхерин 13 (CDH13), кодирующего белок, обеспечивающий контакты между клетками и участвующий в их делении. Генотипы обнаруженного нами локуса объясняют 1.5% разнообразия признака, в то время как известные до сих пор 54 локуса вместе взятые объясняют всего 5% изменчивости. (Приоритетное направление РАН 6.9.; Программа СО РАН 6.9.1.; ИЦиГ СО РАН, д.б.н. Аксенович Т.И.).
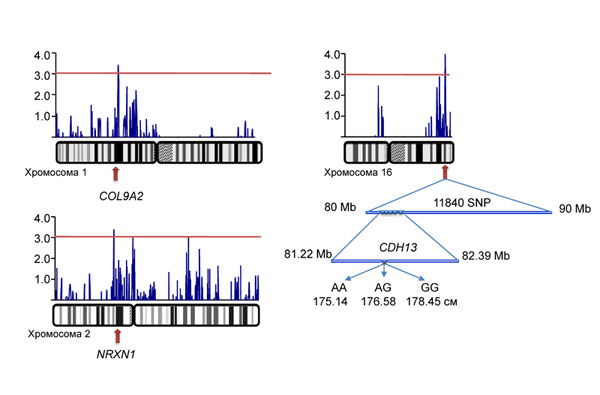
Рис. 8. Результаты тонкого картирования участка хромосомы 16. В районе пика обнаружен кластер из 19 маркеров, достоверно ассоциированных с ростом. Все они локализованы внутри гена кадхерин 13, CDH13. Люди с разными генотипами этих маркеров значительно отличаются по росту.
Cозданы новые генетические конструкции с геном гранулоцит-макрофаг-колониестимулирующего фактора (ГМ-КСФ) человека под контролем 5′-регуляторная область гена ?-S1- казеина козы. ГМ-КСФ наряду с Г-КСФ является важнейшим фактором регуляции гемопоэза. Получены линии трансгенных мышей с экспрессией ГМ-КСФ человека в тканях молочных желез лактирующих самок (рис. 9). Важно отметить, что секреция рекомбинантного ГМ-КСФ человека в сыворотку крови трансгенных самцов и самок вне лактации не выявлена, что свидетельствует об отсутствии эктопической экспрессии трансгена. Уровень экспрессии рекомбинантного белка человека в молоке, определяемый иммуноферментным методом ELISE у трансгенных линий мышей составил от 2000 до 15000 нг/мл. (Приоритетное направление РАН 6.8.; Программа СО РАН 6.8.1.; ИЦиГ СО РАН, д.б.н. Серов О.Л.).
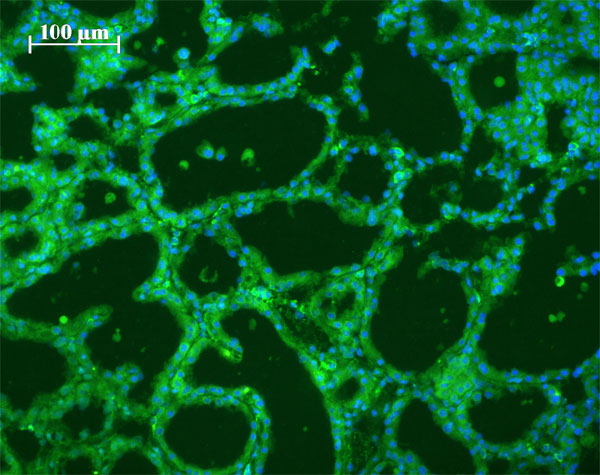
Рис. 9. Иммунофлуоресцентное окрашивание ткани лактирующей молочной железы (зеленый цвет) трансгенной самки на ГМ-КСФ человека (голубой цвет) (х200).
Впервые установлено, что наблюдаемое разнообразие митохондриальной наследственности Drosophila melanogaster связано с цитоплазмтически наследуемым эндосимбионтом Wolbachia. В результате сравнительного анализа геномного полиморфизма митохондриальной ДНК Drosophila melanogaster, инфицированных тремя наиболее распространенными генотипами Wolbachia, выявлена сопряженность гаплотипов митохондрий с конкретными генотипами Wolbachia. На построенной дендрограмме (Рис. 10), отражающей эволюционное ветвление участка митохондриального генома на основе анализа участка 2757 п.н., показано, что один кластер образовали линии дрозофил, носители генотипа Wolbachia – wMel; второй — носители генотипов wMelCS и wMelCS2. Более 99 % всех инфицированных особей являются носителями генотипа wMel, а на оставшиеся два гаплотипа приходится менее 1 %. Впервые показано, что совместное наследование по материнской линии митохондрий Drosophila melanogaster и эндосимбиотической бактерии Wolbachia обнаруживают эволюционную сопряженность геномов. Гаплотипическое разнообразие мтДНК, представленное в популяциях Drosophila melanogaster мира, зависит не только от селективной ценности вариантов митохондрий, но и от селективной ценности цитоплазматически наследуемой бактерии Wolbachia. (Приоритетное направление РАН 6.3.; Программа СО РАН 6.3.1.; ИЦиГ СО РАН, д.б.н. Захаров И.К.).
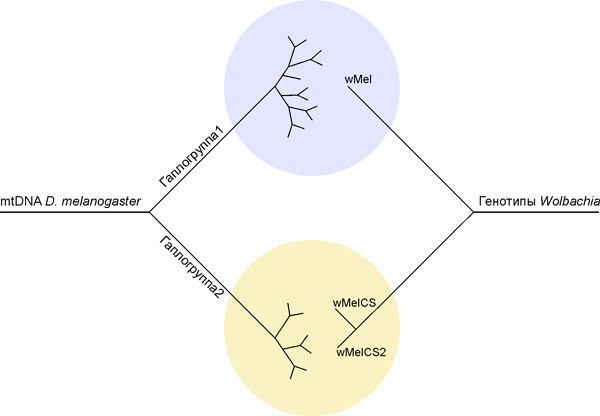
Рис. 10. Иммунофлуоресцентное окрашивание ткани лактирующей молочной железы (зеленый цвет) трансгенной самки на ГМ-КСФ человека (голубой цвет) (х200).
Установлены филогенетические взаимоотношения 39-ти различных видов и подвидов пшениц трех уровней плоидности и 6-ти диплоидных видов рода Aegilops на основе изучения последовательностей хлоропластной ДНК. Найден хлоропластный филогенетический маркер, позволяющий четко различать две основные эволюционные линии рода — Emmer (T. dicoccoides, выделено синим) и Timopheevii (рис.11, выделено зеленым). Экспериментально подтверждена гипотеза об участии только одного вида из секции Sitopsis, а именно Aegilops speltoides (рис.11, красная двойная линия справа), в видообразовании всех полиплоидных пшениц. Показано монофилетическое происхождение А генома всех полиплоидных пшениц от диплоидного вида T. urartu (рис.11, красная одинарная линия). (Приоритетное направление РАН 6.2.; Программа СО РАН 6.2.1.; ИЦиГ СО РАН, д.б.н. Гончаров Н.П.).
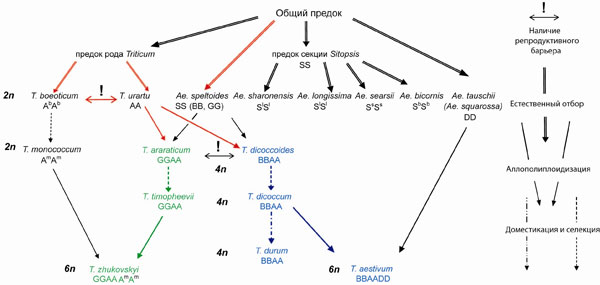
Рис. 11. Схема происхождения полиплоидных видов рода Triticum. Справа даны условные обозначения.
Отработана технология получения растений-реципиентов (Nicotiana tabacum L.) для агроинфильтрации тканей листа с использованием генетической конструкции с геном зеленого флюоресцирующего белка GFP, позволяющая в транзиентной системе экспрессии нарабатывать рекомбинантные белки, в том числе и фармацевтически важные. Принцип метода заключается в иньекции агробактериальной суспензии в ткани листьев табака (рис 12а.). Результаты Вестерн-блот анализа свидетельствуют о том, что маркерный ген GFP, кодирующий зеленый флюоресцентный белок, доставленный в ткани листовых пластинок N.benthamiana методом агроинфильтрации, способен экспрессироваться. Это подтверждается наличием в тканях листовых пластинок белка с молекулярной массой 26,9 kDa (рис 12б.). Данный метод может быть успешно использован в дальнейших работах по накоплению фармацевтически ценных белков в растительных системах. (Приоритетное направление РАН 6.10.; Программа СО РАН 6.10.1.; ИЦиГ СО РАН, д.б.н. Дейнеко Е.В.).
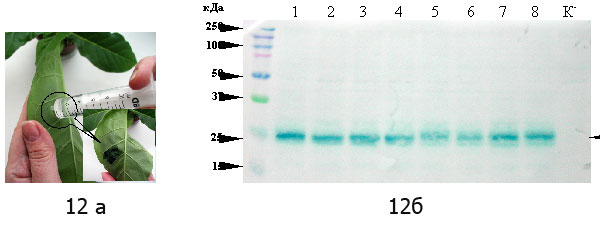
Рис. 12а. Агроинфильтрация растений табака
Рис. 12б.Вестерн-блот анализ экстрактов тканей листовых пластинок табака 1-8 – экстракты из тканей агроинфильтрированных растений; К- — экстракт из тканей растений табака без агроинфильтрации (контроль). Стрелками слева указана молекулярная масса маркеров 15 – 250 кДа. Стрелкой справа указана молекулярная масса GFP-белка.