Ученые НИИКЭЛ разрабатывают клеточную модель ревматоидного артрита для тестирования новых видов терапии
 Научные сотрудники лаборатории фармакологических активных соединений НИИКЭЛ – филиал ИЦиГ СО РАН проанализировали активность ДНК-аптамеров, специфичных к фактору некроза опухоли альфа (ФНО-а), на in vitro модели ревматоидного артрита. Итоги работы были представлены на XII Российском форуме биотехнологий OpenBio-2025.
Научные сотрудники лаборатории фармакологических активных соединений НИИКЭЛ – филиал ИЦиГ СО РАН проанализировали активность ДНК-аптамеров, специфичных к фактору некроза опухоли альфа (ФНО-а), на in vitro модели ревматоидного артрита. Итоги работы были представлены на XII Российском форуме биотехнологий OpenBio-2025.
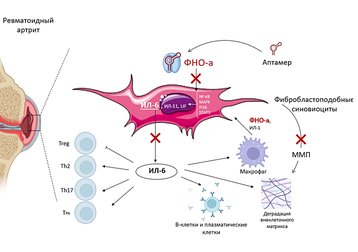
Ревматоидный артрит (РА) – хроническое аутоиммунное заболевание, для которого характерны прогрессирующее воспаление и деструкция суставов. Известно, что ключевую роль в развитии болезни играет регуляторный белок ФНО-α. Ревматоидным артритом страдает около 340 тысяч россиян, и поиски новых средств терапии для этого заболевания остаются актуальной задачей.
Несколько лет назад ученые НИИКЭЛ совместно с коллегами из Института химической биологии и фундаментальной медицины (ИХБФМ) СО РАН приступили к разработке прототипов лекарственных препаратов для терапии ревматических заболеваний и их осложнений на основе ДНК и РНК-аптамеров. Аптамеры относятся к классу синтетических нуклеиновых кислот. Они взаимодействуют с другими молекулами и узнают свои мишени за счет сочетания уникальной последовательности нуклеотидов и сложной пространственной структуры. По своей способности специфично связывать молекулярные мишени аптамеры похожи на моноклональные антитела, применяемые в таргетной терапии. Однако, в отличие от моноклональных антител, аптамеры имеют стопроцентный цифровой двойник, производятся с помощью химического синтеза и не требуют особых условий для транспортировки и хранения.
Первоначально полученные в ИХБФМ СО РАН аптамеры, направленные на ФНО-а, были протестированы на стандартных клеточных линиях. Затем появилась необходимость создать клеточную модель ревматоидного артрита. Такая модель позволяет оценить токсичность разрабатываемого препарата и проверить его эффективность в отношении конкретного заболевания. Для создания модели ученые использовали выделенные от пациентов с ревматоидным артритом фибробластоподобные синовиоциты (ФПС) – специализированные клетки, расположенные внутри суставов в синовиальной оболочке и играющие важную роль в патогенезе хронических воспалительных заболеваний. Банк образцов ревматоидного артрита сейчас включает более 30 образцов и постоянно пополняется.
С помощью 2D-клеточной модели РА ученые исследовали возможность использования ДНК-аптамеров, специфичных к ФНО-α, для подавления его провоспалительной активности.
— При ревматоидном артрите ФНО-α стимулирует синтез интерлейкина-6 (ИЛ-6) и матриксной металлопротеиназы-13 (ММП-13) фибробластоподобными синовиоцитами, запуская каскад реакций, который усиливает воспаление, разрастание синовиальной оболочки и разрушение хряща. Поэтому уровень секреции ИЛ-6 и ММП-13 мы рассматриваем в качестве ключевых маркеров функциональной активности фибробластоподобных синовиоцитов и их ответа на воздействие ФНО-α. Когда мы применили аптамеры, ФНО-α был блокирован, секреция ИЛ-6 и ММП-13 также снизилась и, соответственно, был остановлен процесс развития воспаления. Таким образом с помощью клеточной модели заболевания нам удалось показать, что выбранные ДНК-аптамеры успешно справились со своей задачей – блокировать деструктивные процессы в хряще, — рассказывает аспирант НИИКЭЛ, лаборант-исследователь лаборатории фармакологических активных соединений Дарья Риппинен.
По эффективности воздействия аптамеры оказались сопоставимы с действием моноклональных антител.
Исследования продолжаются. На следующем этапе ученым предстоит создать 3D-клеточную модель заболевания. Если эффективность аптамеров будет показана и на ней, можно будет перейти к испытаниям на животных.
Доклад по итогам работы был представлен на XII Российском форуме биотехнологий OpenBio-2025.
Работа выполнена при финансовой поддержке РНФ № 25-25-00363.